对结核病根除:诊断、耐药性和监测的见解
结核病始于培养
结核病是一种高度传染性的空气传播疾病,在世界范围内的流行率仅次于人类免疫缺陷病毒(HIV),人类史上最致命的疾病[1]。它主要由结核分枝杆菌(Mtb)引起,2014年有960万人感染。虽然世界上没有任何一个社会可以完全避免结核病,但大多数病例出现在亚洲(58%)和非洲(28%)[2,3]。结核病死亡率达到150万人,其中40万人同时感染艾滋病毒[3]。尽管结核病在20多年前就被宣布为一种普遍的公共卫生紧急情况,但结核病死亡人数仍然高得令人无法接受,因此巩固了它作为一个主要全球健康问题的地位。控制结核病的流行受到许多因素的阻碍,其中最主要的是结核分枝杆菌耐药菌株的进化。在与人类宿主共存了数百年之后,这种细菌进化出了复杂的免疫逃逸和传播策略[4],目前存在多药耐药结核病(MDR-TB)和极端耐药结核病(XDR-TB)。其他因素包括艾滋病毒合并感染、目前的卡介苗不足以提供终身免疫力以及缺乏快速、廉价和准确的诊断方法[5]。对多药耐药结核病和极端耐药结核病患者的治疗需要长期使用昂贵且毒性更大的抗生素。临床医生在治疗多药耐药结核病和极端耐药结核病患者时的观察经常包括对治疗有反应的数周后出现矛盾的炎症发作。因此,可用于监测治疗反应的经过验证的生物学或替代标记物的可用性,将非常有助于识别有治疗失败风险的患者,从而给予他们个性化的治疗方案。
结核病带来的威胁和身体抵抗
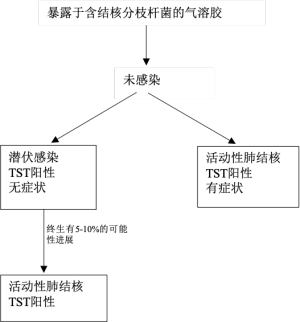
结核分枝杆菌和宿主之间的相互作用是复杂的,许多疾病状态尚不清楚。结核病通常感染肺部(肺结核),导致严重咳嗽、发烧和胸痛,但也可感染人体的任何部位(肺外结核) [6]。它是一种空气飞沫感染,通过吸入来自肺结核患者密切接触者排出的传染性气溶胶细菌而获得。吸入后,一些人会产生有效的免疫反应,从而清除肺部的分枝杆菌。然而,大多数个体发展为无症状潜伏感染,其中结核分枝杆菌的生长被抑制,但处于休眠状态,这些人也不会传播这种疾病。然而,结核分枝杆菌通过快速复制破坏宿主对结核分枝杆菌抑制的终生风险为5 %~ 10%。如图1所示,这种情况只发生在比例相对较小的潜伏感染者身上,这些人随后被称为活动性(原发)结核病患者[7]。另外,这种疾病还可以从肺部传播到其他器官,不仅是大脑、心脏、肺、回肠、肾、骨骼等器官[8]。据世界卫生组织(WHO)统计,全世界约有三分之一的人口患有潜伏性结核病。艾滋病毒感染者和免疫功能低下的人,发展为活动性结核病的风险更高,如接受癌症治疗的人[2]。
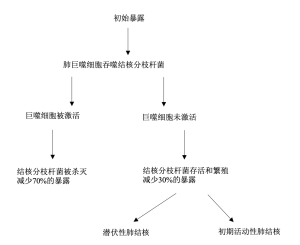
肺结核进展从结核分枝杆菌吸入肺泡腔后开始的。结核分枝杆菌是一种细胞内病原体,当它在肺部遇到肺泡巨噬细胞时,巨噬细胞会吞噬并试图杀死它们。当杀死尝试失败时,杆菌在树突状细胞和巨噬细胞内快速复制,如图2所示。感染的肺泡巨噬细胞可留在肺间质间隙或从肺泡间隙迁移并停留在血管或淋巴管。其他的巨噬细胞和淋巴细胞被招募到受感染的巨噬细胞周围并开始形成所谓的肉芽肿。然后触发IL-1α、IL-1β和其他宿主炎症细胞因子的产生。然而,抗炎细胞因子与这种促炎反应相反,抗炎细胞因子协助感染,使其直到感染约2 - 12周后才被检测到[2]。抗原呈递细胞通过诱导CD4+和CD8+ T细胞激活适应性免疫反应。在此期间,IFN-gamma等细胞因子持续产生,同时分枝杆菌可获得突变,改变其基因表达并逃避T细胞识别[2]。在结核分枝杆菌感染和T细胞应答之间,TB被抑制为一种非活性形式,感染个体无症状,不能传播疾病。在潜伏期的某一时刻,外源因子可以重新激活处于抑制状态的细菌,细菌恢复复制状态[2]。
结核病治疗、耐药性和矛盾的炎症反应
1943年,链霉素被发现对分枝杆菌有效,这是对抗结核病的一个关键突破。随后,其他同样有效的药物被引入使用。然而,由于单种药物使用的选择压力,结核分枝杆菌对这些药物产生了耐药性[6]。目前对药物敏感结核病的治疗包括四种药物联合使用2个月,然后是两种药物联合使用4个月(表1),目的是对抗耐药性。这种治疗方案是最有效的,唯一的缺点是其复杂性、治疗时间长和明显的毒性[9]。
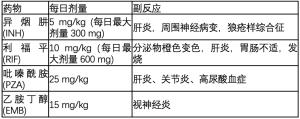
Full table
20世纪90年代中期进行的全球调查显示,结核分枝杆菌对异烟肼和利福平的耐药主要是由于服药不规律和不规范。这导致了二线抗结核药物的引入和使用,即氟喹诺酮类、注射用氨基糖苷类(卡那霉素、阿米卡星)、环肽类药物(卷曲霉素)、对氨基水杨酸、环丝氨酸、丙硫酰胺和噻嗪酮。这些药物虽然更昂贵、有毒且治愈率较低,但由于使用增加,这些药物也未能避免结核分枝杆菌对其产生耐药性,导致出现了极端耐药结核病(XDR-TB) [10-12]。多药耐药结核病病例的数量近年来几乎没有变化。据估计,全球3.3%的新结核病例和20%的以前治疗过的病例患有多药耐药结核病。2014年,估计有19万人死于多药耐药结核病,另外9.7%的多药耐药结核病患者患有极端耐药结核病[3]。
耐药性分类
耐药性结核病包括三大类:单药耐药、多药耐药和广泛耐药。单胞菌耐药是指结核分枝杆菌对其中一种一线抗结核药物耐药。多药耐药结核病被定义为对两种最有效的一线抗结核药物产生耐药性,对利福平(rifampicin, RIF)和异烟肼(INH)耐药,同时对其他任何一线抗结核药物均有或无耐药性[3]。当多药耐药肺结核的微生物对任何氟喹诺酮类药物和至少三种二线注射药物中的一种产生耐药性时,就会出现广泛耐药性[10,13-15]。
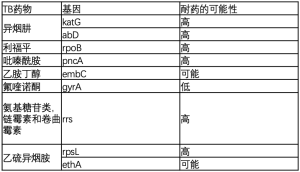
接受药物治疗的结核病感染者可能产生新的耐药性,或通过感染已经具有耐药性的毒株而获得耐药性[12]。普通结核分枝杆菌发展成耐药株是由于分枝杆菌药物靶点基因的自发染色体突变,从而使其在功能上对抗结核化疗不敏感[13]。katG或inhA调节区的突变分别对异烟肼产生了高、低耐药性。利福平耐药性是由于依赖dna的RNA聚合酶b亚基rpo基因的点突变,通常是异烟肼耐药性引起的。其他引起耐药性的基因突变见表2。
与结核病治疗相关的炎症反应被描述为一种矛盾反应,也被称为免疫重建炎症综合征(IRIS)[4]。这通常被定义为既存结核病变的临床或放射学恶化,或在没有疾病复发或存在其他诊断的证据的情况下,患者在抗结核治疗开始好转时出现的新的病变[18,19]。这种反应相对比较频繁,在接受治疗的结核感染患者中,见于6%至30%接受治疗的肺结核患者,但主要出现在10%~15%临床诊断为肺外和播散性结核病的患者中[19]。这种矛盾恶化的临床表现可以在14到270天之间的任何时间发生进展,中位时间为60天。这些症状包括发烧、头痛、精神错乱、局灶性癫痫、胸腔积液出现或恶化。虽然这种矛盾炎症反应的确切发病机制尚不清楚,但对其发展存在一些建议。根据免疫恢复现象的支持者,活动的结核病患者过度表达辅助性T - 2细胞和减少干扰素-γ的产生。在开始抗结核化疗后,分枝杆菌数量显著减少,而治疗前的细胞和细胞因子模式出现逆转。这种对死亡杆菌释放的蛋白质的异常免疫反应可能导致炎症的异常反应[18,20]。目前对这种现象缺乏快速和准确的诊断测试,这意味着只有在排除继发性感染、抗结核治疗不足和治疗引起的不良反应等其他鉴别诊断时,才能确定诊断。
结核病诊断的发展
一个多世纪以来,痰涂片镜检、分枝杆菌培养和胸部x线摄影一直是结核病诊断的基础。然而,随着多药耐药结核病和极端耐药结核病近乎大流行菌株的出现,这些方法的局限性已经暴露出来。这些方法在许多实际条件下执行缓慢、昂贵、复杂且费力[21]。结核控制的主要诊断需求是潜伏性结核病感染的检测、活动性结核病的检测和耐药鉴定。结核病的诊断试验分为两类:从患者材料(通常是痰)中提取的表型细菌接种到含有感兴趣药物的培养基中,检测结核分枝杆菌生长的出现(表明耐药性)或消失(表明易感性),或基因型染色体DNA,以检测已知与耐药性相关的特定突变的存在[22,23]。结核分枝杆菌的耐药性编码在细菌染色体上,因此可以通过分子分析方法进行快速检测,这有助于解决药敏试验表型的挑战。药敏试验需要分枝杆菌培养至少几个月[12]。药物敏感性检测现在尤其重要,因为无法识别和有效治疗多药耐药结核病和极端耐药结核病患者,意味着这些患者将把他们的耐药结核菌株传给其他人。
最近诊断技术的发展是建立在上述两类之一的基础上的。核酸(或直接)扩增试验(NATs)可扩增结核分枝杆菌复合物特异的核酸区域,可用于痰液。对NATs进行的综述表明,尽管它们对肺结核和额外肺结核都有很高的特异性,但在不同的研究中,它们的敏感性较低,且差异较大。由于阴性的NAT检测不能排除结核病的诊断,它们不能用于涂片阴性的标本。环介导等温扩增(Loop-mediated isothermal amplification assay, LAMP)的工作原理与NATs类似,可以表明靶基因上存在6个不同的区域。它具有快速和简单的优势,并已被推荐作为一个替代痰涂片镜检的检测方法在资源贫乏的环境中使用。与培养法相比,它在结核检测中的准确性仍缺乏足够的证据[21,22]。
以抗体检测为重点的免疫学检测也被用于结核病诊断,这些检测面临着严重的缺陷。由于结核分枝杆菌表达的蛋白质和基因依赖于疾病的阶段,因此,它们不具有特异性,不能区分结核、潜伏结核感染和非结核分枝杆菌。因此,目前基于免疫分析的发展将重点放在检测抗原上,例如抗原捕获ELISA和/或循环免疫复合物,而不是抗体。这在完善后将能够明确区分潜伏型和活动性结核病[21]。
另一种基于DNA条的测试是线性探针分析。这些方法依赖于PCR和反向杂交方法来同时检测结核分枝杆菌和任何与耐药性相关的突变。Pai等人写道,当使用培养分离物时,线探针法具有很高的敏感性和特异性,但当直接用于痰液等临床标本时,这种检测方法就失去了这些重要特征。使用基于线探针分析的另一个障碍是它们价格昂贵,而且只能在有较高质量的实验室设备的地方使用。因此,这限制了它们在低收入、高负担国家的使用[21]。
基于分枝杆菌噬菌体的检测利用噬菌体感染结核分枝杆菌。噬菌体复制只能发生在含有活的结核分枝杆菌的样本中,这有助于识别杆菌[22]。当结核分枝杆菌在含有待测药物(如利福平)的样本中检测出时,其耐药性可以被证实。与临床样本相比,这些方法在检测培养分离株的利福平耐药性时也表现出更高的敏感性和特异性[21,22]。
焦磷酸测序是一种基于测序的分子方法,可快速检测与异烟肼、利福平、氟喹诺酮类和注射类药物耐药性相关的特定基因内突变。
显微镜观察药敏试验(MODS)是一种新型、可靠、廉价的检测方法。这种方法可直接从临床(痰)标本中快速检测肺结核和结核分枝杆菌的耐药性。它使用简单的光学显微镜来检测结核杆菌的早期生长。在肉汤培养基中添加或以其他方式添加抗菌药物,使其能够用于药敏试验[21]。MODS分析快速和简单的特性使其成为一种值得优化的工具,尤其适用于资源匮乏的环境中检测二线药物的耐药性和检测极端耐药结核病[24]。
开发更敏感的分子诊断工具将有助于治疗开始前的耐药性疾病检测,从而使患者得到符合其具体需要的化疗。从长远来看,这将有助于抑制耐药结核分枝杆菌菌株的传播[12]。
候选生物标志物和验证策略
临床医生能否监测结核病感染患者对治疗的反应是一个障碍,一旦克服这个障碍,将极大地有助于实现消除结核病的全球目标。目前多药耐药结核病和极端耐药结核病的治疗持续时间很长。在这段时间里,没有有效的替代标记物可用来确定患者是否对治疗有反应。这种限制在发生矛盾的炎症反应时变得更加明显,因为临床医生可能被迫对患者的药物治疗方案进行错误的修补。
生物标记物(或生物标记物)具有可测量的特性。它可以客观反映正常的生物过程、致病过程或对医疗干预的药理学反应。近年来人们对许多生物标志物进行了研究,但很少有具有临床意义的生物标志物成为临床可接受的治疗疗效预测因子[25]。生物标记可以分为静态或动态(或功能)检测。静态分析包括临床样品中特殊物质水平的测量,而动态(或功能)分析则测量一个过程,例如对体内或体外刺激的反应。在监测结核病活动时,一个合适的生物标记应该是不受其他伴随的疾病或治疗所影响的。一种可以预测感染患者分枝杆菌载量早期缓解的潜在生物标志物将是有用的,因为这样的患者将接受短期治疗,并避免不必要的药物毒性效应。同样地,生物标志物可以提示患者处于更高的复发和再激活风险,也可以为相关患者提供特殊的治疗策略[25]。
结核病治疗2个月后的痰液培养状况已被评估作为监测疾病活动的候选生物标志物。然而,它通常是不敏感的,因为只有一半的复发病例可以被识别,也不能提供一个可验证的阳性预测价值,以指导个体患者的治疗。一个有趣的进展是试图找出哪些分枝杆菌标记物可以在尿液中被测量,因为尿液是一种很容易收集的患者产物。一项研究发现一种被称为经肾(tr) DNA的小型结核分枝杆菌IS6110DNA片段在约80%的活动性结核病患者的尿液中检出,但在对照组中未检出。它的优点是有助于监测疾病活动,特别是在那些通常痰液排出困难的儿童中。但该方法需要PCR扩增技术支持,在缺乏PCR扩增技术支持的情况下,对于IS6110拷贝数较低的菌株,检测灵敏度可能不够。一些结核分枝杆菌抗原的抗体水平,如丙氨酸脱氢酶,已被探索为一种潜在的标志物,用于诊断和治疗期间监测疾病的活动,但迄今没有显示出有希望和价值的结果[25]。
监测结核病治疗结果的生物标志物的研究也扩展到非特异性免疫激活标志物。细胞间粘附分子(ICAM) 1是一种白细胞整合素配体,主要由内皮细胞传递。在结核病患者接受诊断时,其可溶形式sICAM1的检测依据疾病的程度而升高,并随着对抗结核药物的反应而降低。一项研究设计包括在药物治疗的第一周sICAM1降低,用以预测2个月的痰液培养转变。其他具有类似预测的基线激活标志物测量包括血清c反应蛋白(CRP)、可溶性尿激酶纤溶酶原激活物受体(suPAR)、可溶性肿瘤坏死因子受体(stnfr1)和sTNFR2。尽管这些基线标志物不能作为治疗效果的指标,但当与其他公认的治疗复发基线标志物(如细菌负荷和空洞疾病的存在)关联时,这些基线标志物可能会给治疗的复发带来提示[25]。
细胞因子在结核中的表达还可以进一步研究,以确定其作为潜在的生物标志物在结核疾病监测中的应用。干扰素γ对于防止分枝杆菌感染是必需的。IFN-γ-诱导蛋白10 (IP-10/CXCL10)是一种在迟发性超敏反应中起作用的趋化因子。CXCL10被认为是肺部疾病炎症的非特异性标志物[26],它有助于Th1细胞对炎症靶点的反应,进一步吸引单核细胞和活化的T淋巴细胞到这些靶点区域。穿透素 3 (PTX3)/促肿瘤坏死因子基因14 (TSG-14)属于穿透素家族,参与损伤、创伤或感染时的急性期反应。在一项评估血浆CXCL10和/或ptx3水平的前瞻性研究中,结果显示,与健康对照组相比,活动性结核病患者中这两个标志物均升高;痊愈的结核病患者血浆中这两种标志物水平均降低;而治疗失败的患者血浆中这两种标志物水平持续升高。因此,在健康接触者的情况下,这些标志物可用于识别有疾病风险的人,或在疾病治疗随访期间使用,以确认治疗疗效或及早识别治疗失败的患者。然而,这些标志物在生物标志物研究中并不像人们想象的那样具有开创性,因为它们仅代表长期活跃的炎症反应的影响。各种外部或内部刺激(不一定是结核病)也会导致IFN-γ、TNF-α和其他促炎因子的产生,导致它们的释放。然而,对于疾病负担高和资源贫乏的国家,这些标志物可通过简单的ELISA检测结合传统的临床标准,以提供疾病结果的早期指示[27]。
总结和未来展望
目前临床上严重依赖药敏试验表型,特别是在疾病负担高和资源贫乏的环境中。这种方法通常太慢,对于除了一线药物和二线注射剂以外的药物也没有充分验证,无法指导个体患者的管理。因此,我支持呼吁世卫组织更加积极主动,将一些关键职能下放给人道主义应急小组和其他全球机构,它们可以在所有疾病负担高的地区实地开展工作[28]。这些机构可以及时发挥技术专长如全基因组测序等,以指导药物干预。最近在巴布亚新几内亚爆发的耐药结核病和世卫组织缓慢的反应强调了这一需要。此外,随着诊断设备技术的进步,全球应针对世界上没有这些设备的国家进行补贴。最终,新种类的抗结核药物、生物标志物和有效的替代终点的发现为疾病根除带来了最大的希望。目前还没有一种具有临床意义地生物标志物用于治疗过程中对疾病的监测,这可能是因为没有单一的生物标志物可以达到这一目的。未来的研究应该着眼于解释疾病发展的复杂手段和所有现有药物作用机制的多种生物标志物。生物标志物和替代终点的发现将在不同人群中区分活动性结核病患者和健康个体,通过药物治疗恢复到正常水平,并可重复预测临床结果,这将是结核病控制的一个重大突破。
Acknowledgments
Funding: None.
Footnote
Conflicts of Interest: The author has completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/jphe.2016.12.12). The author has no conflicts of interest to declare.
Ethical Statement: The author is accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Rahman A, Sahrin M, Afrin S, et al. Comparison of Xpert MTB/RIF Assay and GenoType MTBDRplus DNA Probes for Detection of Mutations Associated with Rifampicin Resistance in Mycobacterium tuberculosis. PLoS One 2016;11:e0152694 [Crossref] [PubMed]
- Fogel N. Tuberculosis: a disease without boundaries. Tuberculosis (Edinb) 2015;95:527-31. [Crossref] [PubMed]
- World Health Organization. Global Tuberculosis Report (2015). WHO/HTM/TB/2015.22
- Ralph AP, Anstey NM, Kelly PM. Tuberculosis into the 2010s: is the glass half full? Clin Infect Dis 2009;49:574-83. [Crossref] [PubMed]
- John SH, Kenneth J, Gandhe AS. Host biomarkers of clinical relevance in tuberculosis: review of gene and protein expression studies. Biomarkers 2012;17:1-8. [Crossref] [PubMed]
- Majewski K, Rybczyńska M, Wódz K. Evaluation of detection and drug resistance of Mycobacterium tuberculosis in patients in the Łódzkie voivodship in 2009-2013. Przegl Epidemiol 2015;69:453-8, 575-80. [PubMed]
- Sridhar S, Pollock K, Lalvani A. Redefining latent tuberculosis. Future Microbiol 2011;6:1021-35. [Crossref] [PubMed]
- Johnson DH, Via LE, Kim P, et al. Nuclear imaging: a powerful novel approach for tuberculosis. Nucl Med Biol 2014;41:777-84. [Crossref] [PubMed]
- Wong EB, Cohen KA, Bishai WR. Rising to the challenge: new therapies for tuberculosis. Trends Microbiol 2013;21:493-501. [Crossref] [PubMed]
- Chakroborty A. Drug-resistant tuberculosis: an insurmountable epidemic? Inflammopharmacology 2011;19:131-7. [Crossref] [PubMed]
- Ajbani K, Shetty A, Mehta A, et al. Rapid diagnosis of extensively drug-resistant tuberculosis by use of a reverse line blot hybridization assay. J Clin Microbiol 2011;49:2546-51. [Crossref] [PubMed]
- Müller B, Borrell S, Rose G, et al. The heterogeneous evolution of multidrug-resistant Mycobacterium tuberculosis. Trends Genet 2013;29:160-9. [Crossref] [PubMed]
- Porvaznik I, Mokry J, Solovic I. Classical against molecular-genetic methods for susceptibility testing of antituberculotics. Adv Exp Med Biol 2015;835:15-22. [Crossref] [PubMed]
- Bonnet M, Pardini M, Meacci F, et al. Treatment of tuberculosis in a region with high drug resistance: outcomes, drug resistance amplification and re-infection. PLoS One 2011;6:e23081 [Crossref] [PubMed]
- Jeon D. Medical Management of Drug-Resistant Tuberculosis. Tuberc Respir Dis (Seoul) 2015;78:168-74. [Crossref] [PubMed]
- Ahmad S, Mokaddas E. Current status and future trends in the diagnosis and treatment of drug-susceptible and multidrug-resistant tuberculosis. J Infect Public Health 2014;7:75-91. [Crossref] [PubMed]
- Outhred AC, Jelfs P, Suliman B, et al. Added value of whole-genome sequencing for management of highly drug-resistant TB. J Antimicrob Chemother 2015;70:1198-202. [PubMed]
- Fernández-Fúnez A. Paradoxical response during anti-tuberculosis treatment in immunocompetent patients. Med Clin (Barc) 2009;133:637-43. [PubMed]
- Brown CS, Smith CJ, Breen RA, et al. Determinants of treatment-related paradoxical reactions during anti-tuberculosis therapy: a case control study. BMC Infectious Diseases 2016;16:479. [Crossref] [PubMed]
- Cheng VC. Paradoxical Response during Anti-tuberculosis Therapy. The Hong Kong Medical Diary. Vol.11 No.1 January 2006.
- Pai M, Kalantri S, Dheda K. New tools and emerging technologies for the diagnosis of tuberculosis: part II. Active tuberculosis and drug resistance. Expert Rev Mol Diagn 2006;6:423-32. [Crossref] [PubMed]
- Grandjean L, Moore DA. Tuberculosis in the developing world: recent advances in diagnosis with special consideration of extensively drug-resistant tuberculosis. Curr Opin Infect Dis 2008;21:454-61. [Crossref] [PubMed]
- Theron G, Peter J, Richardson M, et al. The diagnostic accuracy of the GenoType(®) MTBDRsl assay for the detection of resistance to second-line anti-tuberculosis drugs. Cochrane Database Syst Rev 2014;CD010705 [PubMed]
- Hillery N, Groessl EJ, Trollip A, et al. The Global Consortium for Drug-resistant Tuberculosis Diagnostics (GCDD): design of a multi-site, head-to-head study of three rapid tests to detect extensively drug-resistant tuberculosis. Trials 2014;15:434. [Crossref] [PubMed]
- Wallis RS, Doherty TM, Onyebujoh P, et al. Biomarkers for tuberculosis disease activity, cure, and relapse. Lancet Infect Dis 2009;9:162-72. [Crossref] [PubMed]
- Hasan Z, Rao N, Salahuddin N, et al. Mycobacterium tuberculosis Sonicate-Induced IFNγ, CXCL10 and IL10 can Differentiate Severity in Tuberculosis. Scand J Immunol 2012;75:220-6. [Crossref] [PubMed]
- Azzurri A, Sow OY, Amedei A, et al. IFN-gamma-inducible protein 10 and pentraxin 3 plasma levels are tools for monitoring inflammation and disease activity in Mycobacterium tuberculosis infection. Microbes Infect 2005;7:1-8. [Crossref] [PubMed]
- Negin J, Dhillon RS. Outsourcing: how to reform WHO for the 21st century. BMJ Glob Health 2016;1:e000047 [Crossref]

蒙家嘉
医学硕士,毕业于广西医科大学,就读硕士期间从事病原微生物研究的相关工作。现就职于杭州市西湖区疾病预防控制中心。近3年以第一作者在SCI上发表论文1篇,题目为Lactobacillus xujianguonis sp. nov., isolated from faeces of Marmota himalayana,中国科技核心期刊两篇。(更新时间:2021/9/2)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Sarpong KA. Toward tuberculosis eradication: diagnostic, resistance and monitoring insights. J Public Health Emerg 2017;1:12.